La actividad enzimática se puede inhibir, es decir, reducir o eliminar la actividad enzimática o catalítica de enzimas específicas.
La inhibición puede ser:
Irreversible: el inhibidor se une covalentemente a la enzima, casi siempre a un grupo de la cadena lateral de los amino ácidos en el foco activo. La enzima queda inactiva permanentemente.
Reversible: el inhibidor puede disociarse de la enzima porque no se une por enlaces covalentes. Esta inhibición puede ser competitiva o no-competitiva.
Inhibición Competitiva:el inhibidor competitivo es muy similar al sustrato normal de la enzima. Dada esa similitud estructural, este tipo de inhibidor se une reversiblemente al foco activo de la enzima.
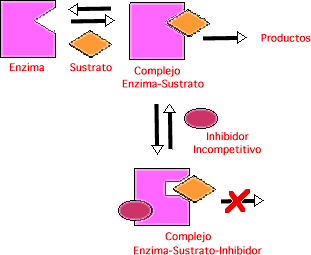
Inhibición Incompetitiva: el inhibidor se combina sólo con ES (no con la enzima), por lo que el inhibidor ejerce su efecto sólo a altas concentraciones de sustrato en las que hay gran cantidad de complejo enzima-sustrato (ES). Por lo tanto, variando la [S] no afecta o evita la unión con el inhibidor. Por otro lado, es evidente que el sustrato y el inhibidor se combinan con la enzima en lugares diferentes.


No hay comentarios:
Publicar un comentario